染色体外环状DNA(ecDNA)是癌症中活化原癌基因扩增的主要方式。区别于常染色体,这类生物大分子主要以环状的形式存在于细胞核当中,长度分布在10的3次方到6次方数量级,无中心粒。ecDNA序列中包含一个或者多个基因与调控元件,结构开放,转录活性强,相比于在棒状染色体结构基因,ecDNA的生物功能活性更强。癌症中,成环的基因区域拷贝数往往增高,而超过一半的高拷贝数事件是ecDNA驱动生成。

图1 ecDNA (https://boundlessbio.com/what-we-do/)
ecDNA出现在14%的原发性癌症和超过40%的转移性癌症中,而在正常组织中很少见到。ecDNA可以驱动部分基因发生扩增形成高拷贝数,在遗传过程中不遵循孟德尔定律,可以实现在子代细胞的快速积累和随机分配,驱动肿瘤快速进化,在药物治疗的环境中逐步增强原癌基因表达的依赖性。肿瘤细胞中一旦发生这种基因扩增,免疫治疗或者靶向治疗往往是无效的。
可以把ecDNA比做一个工厂,这个工厂的成立形式多样且功能独立,有趣的是由该工厂加工得到的产品(ecDNA)可重新整合至原染色体当中,从而增强肿瘤基因异质性;同时,一座座工厂协同合作,当地处邻近区域时(空间位置),以其中某个工厂作为“hub”有序的推进癌细胞中原癌基因的表达,帮助癌细胞进化,耐药,所以如何摧毁这些工厂是生物学家接下来需要思考的重要问题。
“ecDNA相关研究的快速发展能够帮助解释为什么发生原癌基因扩增的癌细胞恶性程度更高,为什么传统的治疗方法对于许多晚期病人无效。”ecDNA研究引领者,Paul S.Mischel说到,“ecDNA的相关研究为创新性、个性化治疗带来了新的希望,有望在未来帮助更多恶性肿瘤患者”。
实际上围绕ecDNA与耐药相关的讨论从未停止,Peter J.Campbell 和Don W.Cleveland合作,于2020年发表在Nature上的文章就报道了ecDNA是如何驱动基因扩增从让癌细胞发生耐药现象的相关研究。文章第一作者Ofer Shoshani博士谈到“耐药是癌症治疗中遇到的最大麻烦之一,如果能有效解决这一问题,许多患者的生存期一定会得到延长”,在2017年Paul S.Mischel发表在Nature上的文章也报道ecDNA驱动肿瘤进化和异质性问题。
1. ecDNA在多种癌症中广泛存在
2017年发表的Nature文章尝试通过WGS数据分析获得ecDNA的相关信息,通过全基因组测序对17个不同的癌症类型的2572个处于有丝分裂中期的细胞进行测序整合分析,已经发现ecDNA存在于半数以上人类癌症中,不同癌症中成环的频率不同,但在正常细胞中几乎不见踪影。数据模型预测认为相比于棒状染色体结构的基因元件,ecDNA扩增原癌基因的效率更高,从而获得结论,ecDNA是加速癌症进化的重要原因之一。
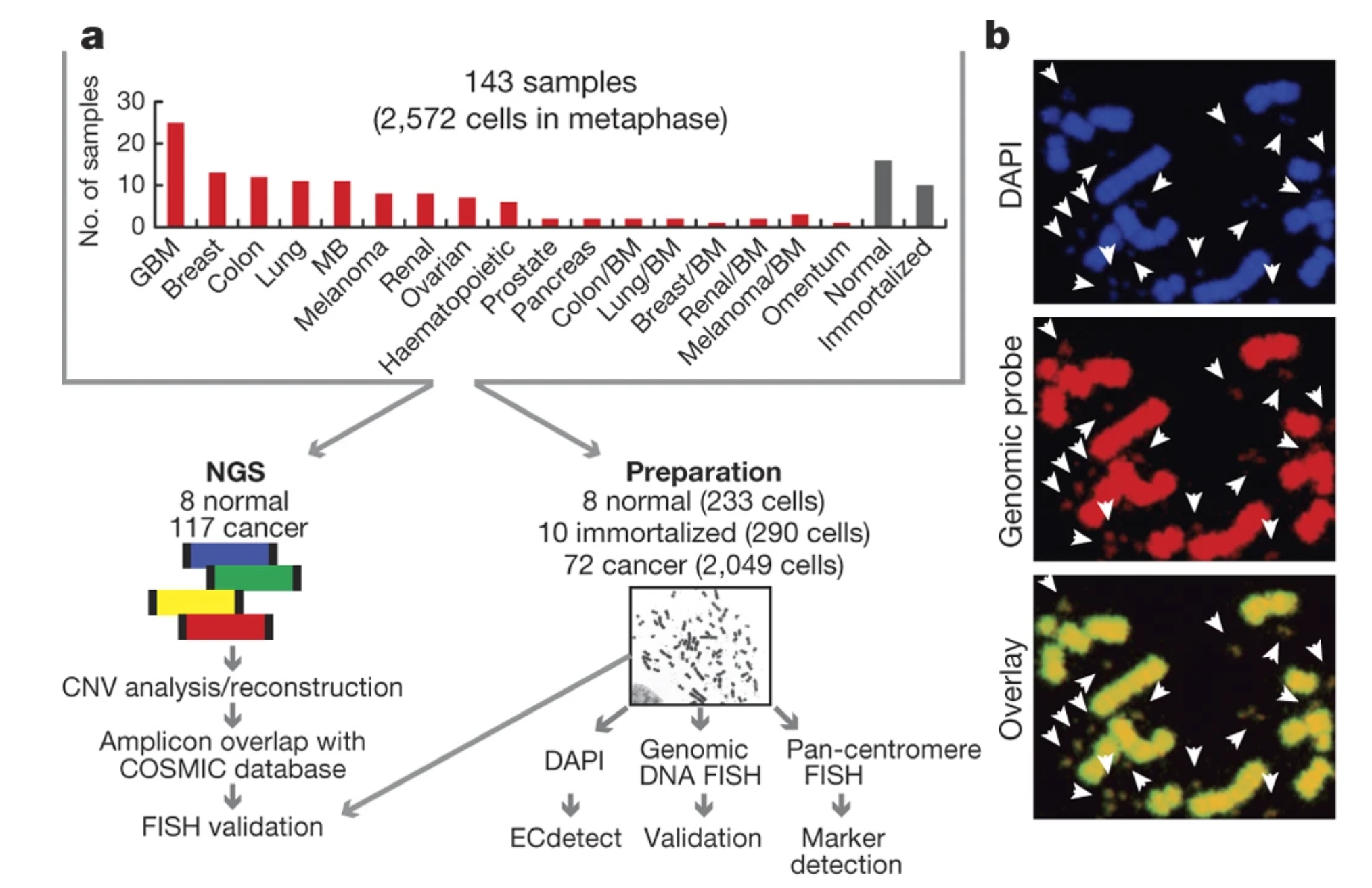
图2 ecDNA广泛存在于多种癌症中(https://doi.org/10.1038/nature21356)
整个实验对143份样品(处于染色体中期的共2572个细胞)进行WGS检测,其中对比117例与8例正常对照,结合FISH结果进行验证,发现ecDNA广泛存在与人类癌症样本中,但正常样本中并没有发现ecDNA存在。
2. ecDNA是染色体碎裂与重组的产物
Peter和Don的文章中指出,染色体碎裂(chromothripsis)现象与随机再组装是ecDNA生物合成的主要途径,Ofer认为这篇文章的主要贡献正是指出染色体碎裂同ecDNA形成的相关性。基因扩增现象在甲氨蝶呤(methotrexate)耐药细胞中被首次发现,起初的研究主要关注的是短的染色体外环状DNA(ecDNA,被称为double minutes, DMs),有研究也证明这种DMs可以重新整合到染色体当中。WGS数据分析能够清晰的给出基因重组的证明,比如基因扩增和碎裂,而染色体碎裂是一种非常剧烈的染色体碎片化过程,之后这些碎片以几乎随机的方式重新链接起来。ecDNA的生物形成可能性有很多,BFB(breakage-fusion-bridge,断裂融合桥)、染色体内的串联复制(Intrachromosomal tandem duplications)或者肉瘤当中发现的新染色体(neochromosome)都有可能形成ecDNA。这篇文章重点强调的另一方面是,在细胞外界不断施加选择压力时,包括ecDNA在内的染色体外生物结构是如何应答的。
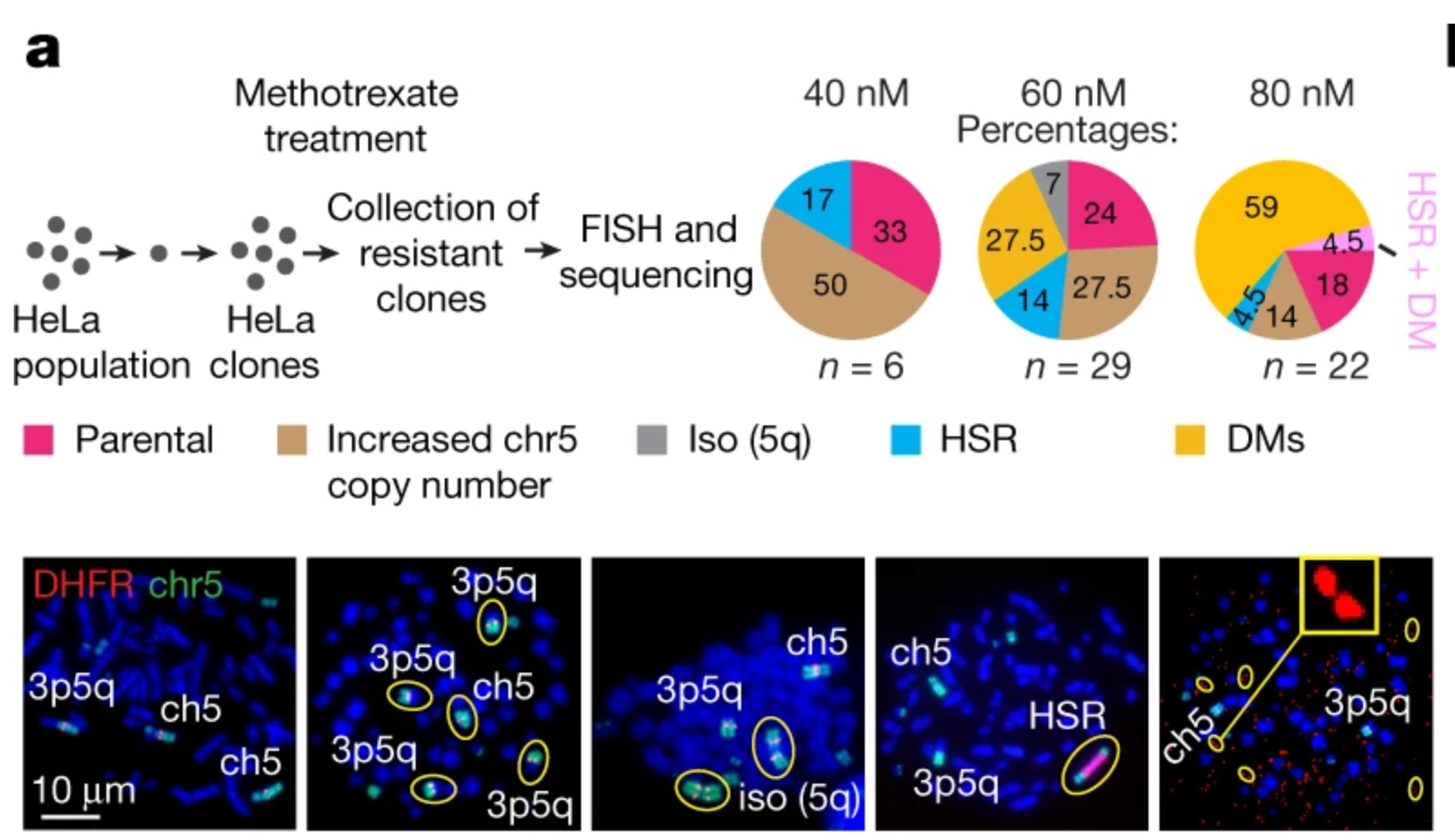
图3选择压力与ecDNA的形成(https://doi.org/10.1038/s41586-020-03064-z)
随着甲氨蝶呤浓度的增加(40,60到80nM),选择压力不断增加,具有抗性的Hela细胞中DMs所占比例也在不断增加,可知ecDNA比例会随着选择压力的增加而增加,而之后的结果证明伴随选择压力的增加,染色体碎裂可以优化ecDNA的结果,驱动ecDNA结构的进化与整合,这种逐步的、动态的响应最终导致包括DHFR在内的部分基因拷贝数增加。此项研究的意义是通过break-fusion-bridge将环状DNA和染色体碎裂这两个被发现了超过70年的生物现象相连接,这种染色体碎裂片段的优化和整合被描述为依赖于NHEJ(Non-homologous end joining,非同源末端连接)和PARP(polyADP-ribose polymerases)的生物过程,文章指出,既然像甲氨蝶呤和维莫非尼(vemurafenib)在内的化疗药物能够引起染色体碎裂之后的片段重组与ecDNA形式的原癌基因扩增,那么靶向药物结合DNA修复抑制剂或许可以有效的阻止癌细胞的进化、侵袭甚至耐药现象的发生,从而带来肿瘤治疗方法带来新的思路。
3. 多个ecDNA协同合作增强原癌基因表达
ecDNA形式的原癌基因扩增与耐药有关,生物学的具体是如何体现的?2021年发表的Nature文章建立了ecDNA扩增与原癌基因表达之间的关系,文章报道的10-100个ecDNA以cluster的形式实现增强子-基因相互作用的方式来驱动原癌基因的表达。
在之前的研究中已经发现了ecDNA可以增强原癌基因的表达,但似乎之前的理解中,研究者远远的低估了ecDNA对原癌基因表达驱动的能力和方式的多样性。当ecDNA在空间上同其他ecDNA聚集捆绑的时候,这种捆绑以某个ecDNA为核心(hub),其他ecDNA辅助,使转录原癌基因的可能性大大增加,例如,在结直肠癌细胞系中,BRD4捆绑的ecDNA促进MYC的表达,而JQ1可以驱散(disperse)这群ecDNA从而达到抑制ecDNA原癌基因转录的活性,BRD4结合的PVT1启动子与MYC融合以ecDNA的形式扩增,在其他ecDNA携带的enhancer的辅助帮助下强有力的促进了MYC的表达,CRISPR技术对ecDNA enhancer的干扰可以有效的阻止这种ecDNA特有的enhancer-gene的转录活化模式,这种合作性质的肿瘤进化机制(cooperative evolution)或许可以为癌症治疗提供新的思路和方向。
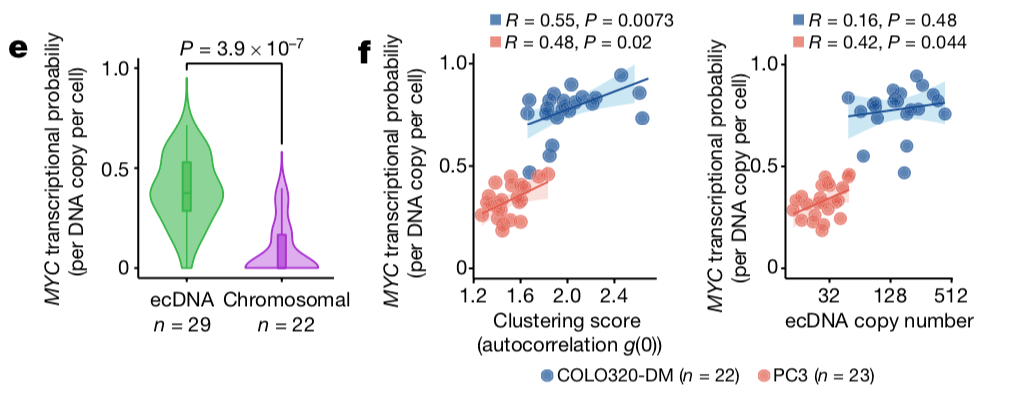
图4 ecDNA聚集程度影响原癌基因表达(doi: 10.1038/s41586-021-04116-8)
上图的f结果可以看出ecDNA的聚集情况(clustering score)同MYC的转录概率成正相关,当携带有各种调控元件的ecDNA捆绑在一起时,MYC的转录概率增大,具体的结构在文章的后半部分做了详细描述。
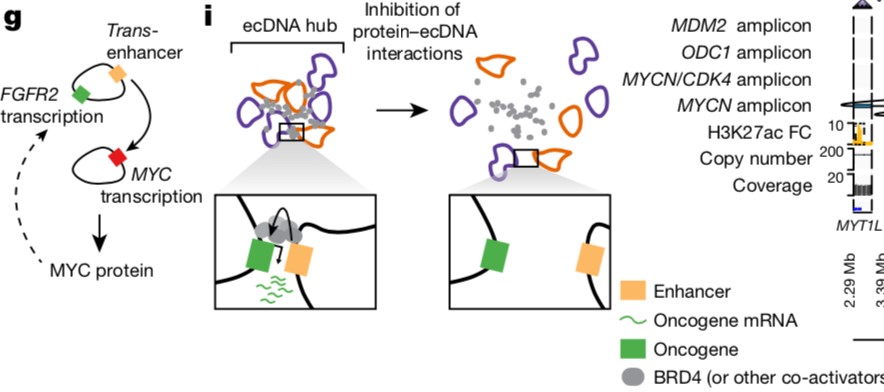
图5 ecDNA协同合作促进癌基因表达(doi: 10.1038/s41586-021-04116-8)
上图的g和i展示的内容是一个非常庞大的ecDNA团体,多个ecDNA聚集在一起成为一个cluster,这些ecDNA贡献了增强子,原癌基因,图中的灰色部分BRD4蛋白作为中间介质,将多个ecDNA捆绑(tether)在一起,在这个聚集体中增强子对原癌基因的启动活性增强从而对原癌基因表达进行扩增,如果存在JQ1抑制因素,可以驱散这个ecDNA聚集体,让增强子和原癌基因在空间上形成隔离,从而无法对原癌基因进行转录激活加强。i图是一个典型的ecDNA合作扩增模式图,而g图中给出的是不同ecDNA之间的相互作用,即携带有不同原癌基因ecDNA相互作用协同发挥功能的模式图。由此可以看出,ecDNA的原癌基因表达增强活性实际上非常依赖于各种协同因子保持空间上的紧密关系,如果实验干预破坏多分子的紧密关系,扩增的效果会被大大的削弱,对这一点的深入理解对于临床应用具有重要的意义。

图6 ecDNA(https://doi.org/10.1038/s41586-019-1763-5)
4. ecDNA的探索方法与模式
深入理解ecDNA促进原癌基因表达的作用,必须更清楚的了解ecDNA本身特征。ecDNA的拓扑异构特征如何?同棒状染色体有何不同?首先ecDNA是环状结构,使用AA算法(AmpliconArchitecutre)对WGS数据分析可以找到线性或者环状扩增子,而环状结构的存在可以被多个discordant reads支持,sanger测序也能对这种反式剪切的结构进行验证。对于ecDNA结构的重塑和空间结构的理解,本文提到的几篇文章均使用了多种组学联合的方式,对整个染色体外结构进行探索。
1)最直接的方法是使用显微技术、原位染色、扫描电镜等技术对处于有丝分裂中期的癌细胞进行直接染色观察;
2)ecDNA的转录活性离不开转录因子的帮助,因此ChIP-seq检测发现H3K4me1和H3K27ac修饰marker存在于ecDNA;
3)虽然ecDNA具有一定的高级结构,但是这种结构还无法像棒状染色体一样紧密,ATAC-seq测序数据分析可以发现ecDNA具有一定开放性的染色体结构,对应的,ATAC-seq信号的数量相对更多;
4)4C/3C-seq,重现染色体远距离通讯的重要手段。
5)circDNA-seq,消化线性DNA,纯化感兴趣的环状DNA分子进行扩增测序;
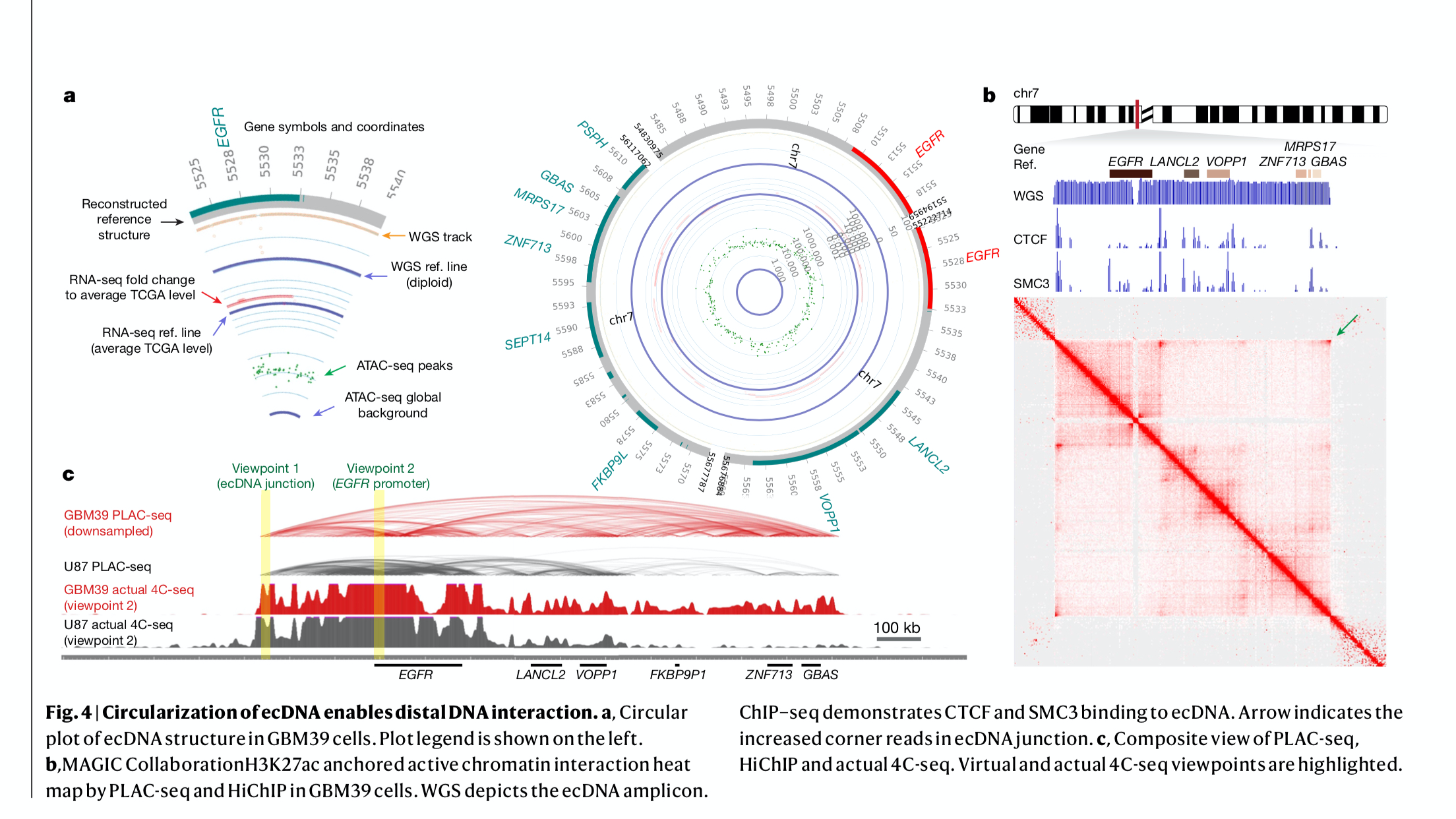
图7 ecDNA环化导致DNA远距离互作(https://doi.org/10.1038/s41586-019-1763-5)
多组学联分析重现ecDNA的典型案例如上图所示,其中circOS图展现了包括RNA-seq、ATAC-seq、WGS、PLAC-seq(4C-seq+ChIP-seq)等多个组学的信息,使用WGS分析拷贝数变化,寻找扩增子,使用ATAC-seq分析成环区域的染色质开放性,使用RNA-seq同时分析该区域的转录结果,通过PLAC-seq或4C-seq分析成环区域的基因远距离相互联系,ChIP-seq分析在部分位置是否存在表观遗传修饰。通过多组学分析将ecDNA的环境同下游表达同时进行展示。
ecDNA的研究在最近的三年内受到广泛的关注,目前相关研究仍然处于早期阶段,有关ecDNA的生物合成,调控机制,下游功能还有很多的问题需要回答,但是可以预见的是未来几年内,尤其在肿瘤研究当中,ecDNA同耐药与治疗的关系会一直是焦点。在之后的研究当中,我们会更加详细的介绍有关ecDNA的高通量测序方法和分析策略,让广大科研人员了解ecDNA的研究前沿。
关于我们:
纽科生物提供专业的生物信息学数据分析和高通量测序服务。目前,公司已经和四川大学、复旦大学、上海交通大学、中山医院、华中科技大学等多所医院、高校的研究团队建立了长期良好的合作关系,提供高品质的数据分析和测序服务,帮助客户在European Journal of Heart、Circulation Research、Nature Communications等多个著名杂志期刊上发表高水平科研文章,欢迎各位老师前来咨询。